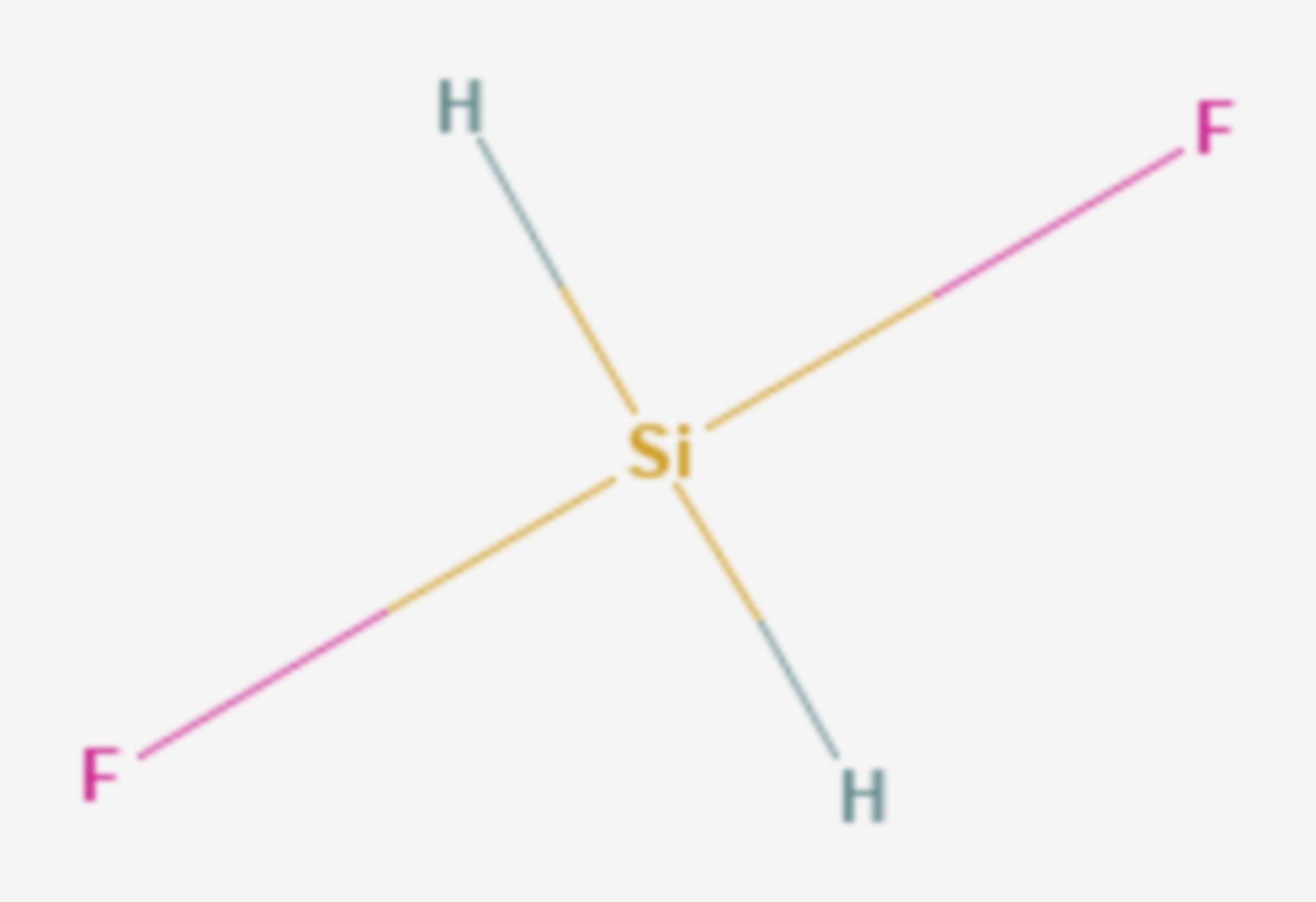
Difluoramin ist eine chemische Verbindung aus der Gruppe der Stickstoffhalogenide.
Gewinnung und Darstellung
Difluoramin kann durch Hydrolyse von N,N-Difluorharnstoff gewonnen werden.
Auch die Herstellung durch Spaltung von Tetrafluorhydrazin mit Thiophenol ist möglich.
Es entsteht auch als Beiprodukt bei der Reduktion von Stickstofftrifluorid mit Arsen oder der Fluorierung von Harnstoff. Ebenso (wie andere Stickstoffhalogenide) entsteht es bei der Elektrolyse von Ammoniumhydrogendifluorid.
Eigenschaften
Difluoramin ist ein explosives farbloses Gas, das 1931 durch Otto Ruff entdeckt wurde. Es stellt eine Säure dar und reagiert mit Basen unter Bildung des Difluoramid-Ions NF2− Das Molekül besitzt eine pyramidale Struktur mit dem Stickstoff an der Spitze. Bei Anwesenheit von Kaliumfluorid zersetzt es sich in Difluordiimin und Fluorwasserstoff.
Weblinks
- R. J. Douthart, J. N. Keith, W. K. Sumida: Reactions of difluoramine with lewis acids, doi:10.1021/ba-1966-0054.ch014
Einzelnachweise